我们的记忆,源于DNA瓦解?
记忆的延续勾勒出一道向前奔流的时间河,承载着永恒的时光之旅。
西班牙超现实主义者萨尔瓦多·达利在他的著名作品《记忆的永恒》中图解了这副场景:柔软的时间在生命枝头永恒;但在量子时代到来之后,这位常思不衰的艺术家瓦解了自己的创作:《一条高彩鱼眼的染色体启动永恒记忆的和谐分解》,被后世称之为“记忆的永恒的解体”。
然而,达利可能没有想到的是,染色体所包含的遗传物质DNA的断裂可能是新记忆的一大源头。近日,美国西北大学范伯格医学院约瓦舍维奇(Vladimir Jovasevic)和他的同事们在《自然》杂志上的文章中为这个谜题增添了一个重要的解释:双链DNA的损伤和再修复会在一些离散的神经元中,启动先天免疫,成为记忆的源头。

▷Vladimir Jovasevic, Vladimir, et al. "Formation of memory assemblies through the DNA-sensing TLR9 pathway." Nature 628.8006 (2024): 145-153.
从西蒙出发:记忆存在于特定细胞簇中
大脑储存记忆吗?这个在当代神经科学中看似显而易见的主题,就在一个世纪前,在学习和记忆领域的主要学者中进行了激烈的辩论。对一些人来说,很明显,记忆是在大脑中物理表现的,但另一些人则认为它存储在更为精神化的心智中。
1904年,理查德·西蒙(Richard Semon)书写了两本巨著(Die Mneme和Die Mnemischen Empfindungen)提出了人类记忆的物理理论。
他引入了“印迹”(Engram)一词,认为大脑的状态和结构会随着人的经历做出反应,这种反应应当是物理性的。这意味着脑内存在一类“神经基质”,用于存储和再现记忆。“印迹”一旦形成,就会进入休眠状态,当曾经的事件再次发生,便会再次唤醒记忆。
实验科学发展之下,物理实存的观点逐渐得到证实。
生理心理学先驱卡尔·拉什利(Karl Spencer Lashley)最早开启了寻找“印迹”的旅程,他通过消融大脑皮层的不同部分,观察老鼠在迷宫中的行为,却以失败告终。但困惑之余,拉什利仍然坚信印迹实存——只不过是散布式的:“并不是找到痕迹在哪里,而是找到它不在的地方”[1]。
当拉什利的学生,心理学家和记忆理论家唐纳德·赫布(Donald O. Hebb)提出细胞组装理论(类似于西蒙的印迹复合体)时,印迹相关研究的下一个飞跃出现了。赫布假设一个细胞集合是在相互连接的细胞之间形成的,这些细胞在刺激期间同时活跃。细胞组合内足够的活动诱导生长和代谢变化,从而加强这些细胞之间的联系。这些突触和代谢变化(可能包括内在神经元兴奋性的变化)对细胞组装的功能有影响。
随着更先进技术的出现,寻找记忆细胞的探索迎来了彻底的复兴。通过标记示踪和靶向单个神经元的干预策略(激活或消融),人们终于发现了一组神经元:在记忆产生时,它们会有即时反应基因的迅速高表达,消融这部分神经元,记忆将无法产生(必要性),人为激活这部分神经元,记忆将被人为塑造(充分性)[2] 。
印迹细胞的发现证明记忆确实存在于特定的神经元群体以及它们的交互环路中。
现在,神经科学家正致力于确定海马体中的神经元群如何对诱导记忆的刺激做出反应。
印迹细胞中存在DNA损伤再修复
“印迹”指的是由学习引起的持久的离线物理和/或化学变化,这些变化是新形成的记忆关联的基础。具有这种物理记忆痕迹的神经元(记忆印迹细胞),通常是在特定经历中表达即时反应基因的神经元[3]。
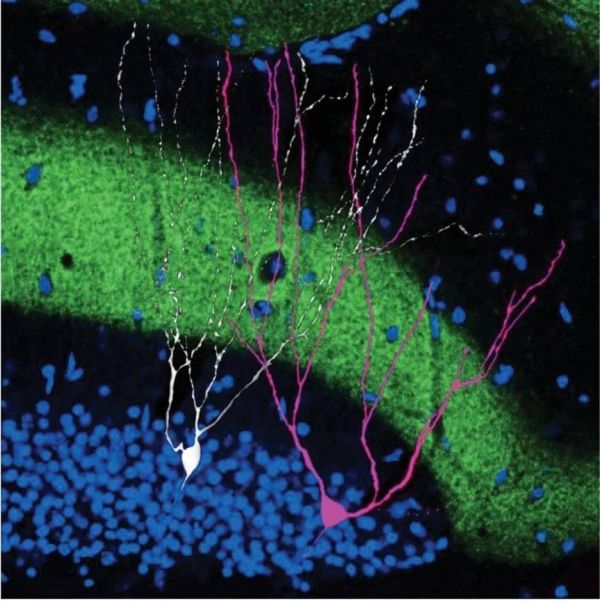
▷与非印迹细胞(白)相邻的印迹细胞(粉)。来源:science
通常认为,外界刺激下的神经元活动可以诱发即时反应基因在印迹细胞中表达,这是印迹形成的物理基础。
2015年,麻省理工学院(MIT)的大脑与认知科学系教授蔡立慧(Li-Huei Tsai)研究团队使用分子和全基因组的新一代测序方法,发现神经元活动刺激在即时反应基因(IEG,如Fos, Npas4和Egr1)的启动子中,可以触发DNA双链断裂(DNA double-strand breaks,DSBs)的形成。即使在没有外部刺激的情况下,靶向诱导即时反应基因的启动子区域的DSB,也足以诱导即时反应基因的表达[4]。
即时反应基因的表达通常受到DNA拓扑约束的抑制,DNA双链断裂可以帮助快速解除这些约束。即DNA双链断裂在即时反应基因表达、学习和记忆中的存在重要作用。
DNA双链断裂与记忆的历史
保持DNA的完整性对于基因的忠实表达至关重要。然而,在正常的细胞功能过程中,DNA容易受到多种形式的损伤。据估计,每个细胞每天可能遭受多达数万次的DNA损伤,其中包括碱基对不匹配,氧化碱损伤,单链断裂和双链断裂。所有类型的DNA损伤都有可能导致不良后果,如细胞凋亡或肿瘤发生。
其中,双链断裂被认为是最具细胞毒性的,它不仅对遗传和表观遗传信息的保存构成严重威胁,也可作为细胞死亡的信号。众所周知,由电离辐射产生的双链断裂是突变、染色体畸变、遗传不稳定和致癌背后的主要致病因素之一。
然而,并非所有的DNA双链断裂都是病理性的。在健康的功能细胞中,有丝分裂过程中形成的双链断裂通过同源重组进行修复;而在损伤诱导或非分裂细胞中的DNA双链断裂,主要通过非同源末端连接修复。这两种机制为忠实和有效的DNA双链断裂修复提供了保障,在免疫系统中发挥着重要的适应性作用,维持了损伤病理与适应性免疫之间的细微界限。
在中枢神经系统中,DNA的损伤再修复平衡与记忆似乎更加难以捉摸。在衰老和疾病状态下,DNA双链断裂增加。研究显示,海马体中的DNA双链断裂在整个生命周期中都被认为对学习和记忆有害。将小鼠反复暴露于低剂量辐射中,观察到小鼠的海马齿状回存在持续的DNA双链断裂,这导致了神经发生的减少,并最终降低小鼠的存活率[5]。
但同时,科学家们很早就发现,DNA双链断裂可能参与了记忆过程。在情境恐惧记忆检索后,海马中活性转录标记组蛋白H3赖氨酸-4三甲基化(H3K4me3)增加,这是DNA双链断裂出现的标志之一。然而,这种表观遗传标记在再巩固过程中是如何调节的,尚不明确[6]。
如果DNA双链断裂参与学习和记忆,那么从药物上诱导DNA双链断裂会损害记忆,这似乎是违反直觉的。一个可能的原因是,在没有行为体验的情况下,DNA双链断裂的增加可能有害,并且可能遏制行为体验所触发的DNA双链断裂;另一种情况是,药物诱导和行为体验可能共同触发某些特定区域的DNA双链断裂,而单独的DNA双链断裂事件可能不足以引发记忆形成。此外,也有可能部分记忆信号与DNA双链断裂的修复有关。
这些数据表明,DNA双链断裂在中枢神经系统中具有适应性作用。
区别于印迹细胞,一类新的神经元簇
至此,DNA双链断裂似乎与印迹细胞高度绑定,成为了探索印迹细胞工作模式的一条通路。
约瓦舍维奇团队发现了另一群神经元:他们发现,在与表达即时早期基因的神经元群体截然不同的另一神经元群体中,恐惧记忆诱导的DNA损伤再修复成为长期记忆的一个源头,记忆刺激所诱导的DNA损伤可以联系到长期记忆相关的持续细胞变化。
约瓦舍维奇团队对小鼠进行情境恐惧条件反射训练,他们发现:
(1)在训练了小鼠的恐惧条件记忆后4天(可理解为短期记忆期),小鼠的海马中即显示出了DNA和细胞核损伤。
(2)观察恐惧记忆刺激后21天的小鼠(可理解为长期记忆期),发现最近记忆时间点的小鼠海马显示出炎症迹象,蛋白质Toll样受体9(TLR9)的信号被激活,并触发了胞质DNA的先天免疫反应。这通常是机体抵御细菌感染的反应。

▷炎性神经元与印记神经元的记忆形成机制。图源:nature
尽管大多数DNA双链断裂都能迅速修复,但那些持续存在的DNA双链断裂显示出一种特殊的中心体定位——中心体是一种以其在细胞分裂中的作用而闻名的细胞结构,但它在DNA损伤反应中也扮演着越来越重要的角色。
在中心体内,DNA形成了一个关键的损伤反应复合体,该复合体还包括蛋白53BP1,这是双链DNA断裂修复的关键介质。研究表明,从海马神经元中去除Toll样受体9 可以防止中心体DNA损伤和DNA修复复合物的积累,这表明Toll样受体9 信号传导在神经元中的一个关键功能是维持基因组的完整性。
约瓦舍维奇等人进一步证明了转录因子RELA是如何定位到中心体的。这些发现为记忆的获取与其长期可靠存储之间建立了分子层面的联系,为这些炎性神经元的鉴定提供了实质性的见解。
那么,这些特异性的炎性神经元簇与印迹细胞存在怎样的相互作用呢? 研究人员推测,炎症神经元可能在记忆的稳定性和灵活性中起着关键作用,但印迹神经元则负责激发记忆的回忆。
对印迹神经元的研究表明,转录因子CREB的基线表达,是记忆中活动诱导基因表达的启动子,启动单个神经元被招募到印迹中。炎症细胞群中可能存在类似的机制。DNA损伤可能会使某些神经元在学习后发生持续性DNA损伤和先天免疫反应。
作者推测,印迹神经元可能产生了最初的记忆信号,而炎症神经元则通过支持和塑造记忆,帮助记忆得以持续存在。
回到西蒙:记忆与遗传
在Die Mneme一书中,理查德·西蒙还提出了一个更广泛的统一理论,强调了记忆和遗传之间的相似性。这出于他的朴素观察:父母的学习与经验可以传递给后代。这种“软遗传”观点,最初来自于拉马克。
相比于印迹学说,西蒙所提出的代际记忆遗传学说似乎更为耸人听闻,一经提出,便与拉马克的学说一起被长久地抛弃在角落。只有疯狂乐观的人才愿意扛起复兴的火种。
上世纪五六十年代,密歇根大学的实验心理学家詹姆斯·麦康奈尔(James V McConnell)和他的同事们用涡虫来研究记忆过程。曾经掀起记忆软遗传的复兴。他利用涡虫的再生能力进行实验,将一只受过训练的涡虫一分为二。他发现两只新的涡虫都保留了一些记忆,表现为更快地完成训练。更加神奇的是,将训练有素的涡虫捣碎,将它们喂给未经训练的涡虫。这些涡虫也更容易完成训练任务,好似记忆通过物质在转移。
这些难以置信的实验结果在当时便引起了广泛的争议。科学界有相当一部分人不相信这些实验,他们认为只需要一些适当的控制加上难以避免的观察者偏见,就可以得出类似的结论。
麦康奈尔由于长期的质疑成为了大众媒体的众矢之的,以至于收到含有炸弹的信件,最终导致他失去了听力。
但在2013年,由美国马萨诸塞州塔夫茨大学生物学家塔尔·肖姆拉特(Tal Shomrat)和迈克尔·莱文(Michael Levin)领导的一个小组发表了一篇论文,他们使用不同粗糙程度的地板和变化的光照作为适应性记忆的线索,测试了斩首后蠕虫对先前环境的快速适应,从根本上支持了麦康奈尔的发现[7]。
同年,来自美国埃默里大学的布莱恩·迪亚斯(Brian Dias)小组更是在哺乳动物中发现了代际遗传的可能:小鼠可以将对刺激性气味苯丙酮的恐惧嗅觉记忆遗传给其F1代。曾经被弃置角落的代际记忆遗传再次被提及[8]。
正如前文所说,DNA损伤会逐渐积累起组蛋白的翻译后修饰,这可能是记忆形成的关键。与表观遗传学研究类似,DNA双链损伤再修复可能是将信息传递给后代的印记的重要组成部分。
通过染色质免疫沉淀(ChIP)分析,研究人员发现,在记忆的再巩固过程中,海马CA1区的DNA双链损伤和组蛋白H3第四位赖氨酸甲基化(H3K4me3)之间存在显著的重叠。此外,组蛋白H2A的磷酸化(H2A.XpS139)和H3K4me3水平与长期记忆受损有关,表明DNA双链损伤再修复在记忆再巩固过程中起着不可或缺的作用。同时,组蛋白H2B在赖氨酸120位点(H2Bub)的单泛素化对海马记忆形成至关重要[6]。
总的来说,DNA双链断裂增加表观遗传介导的转录控制,可能是一种新的记忆再巩固机制。印记的故事似乎又一次回到了西蒙。
展望
当然,定义一类新的细胞簇是孤掌难鸣的。印迹细胞在十年前的学术界掀起浪潮,是由当时同时涌现的诸多研究,构成了扎实的三维验证(观察性研究、敲除必要性研究、敲入充分性)。
针对约瓦舍维奇的研究,如何确定这类特异的炎性神经元,又如何将其与其他神经元区分开来,仍是目前需要面对的问题。特别是考虑到DNA损伤在衰老和神经变性中起着关键作用,这些炎症神经元的出现也提出了一个紧迫的问题:Toll样受体9的激活,通常是通过中枢神经系统的免疫细胞小胶质细胞进行,这类炎症反应通常会导致神经退行性变。那么,为什么在神经元中,Toll样受体9的激活则走向了对立面,即参与记忆的形成呢?
我们又该如何区分有害的DNA损伤和炎症与记忆所必需的免疫反应呢?
这簇神经元在获取、巩固或检索记忆过程中的活动或功能特性仍不清楚。在整个记忆过程中,需要记录电活动和选择性地操纵炎症神经元,以更好地理解细胞对记忆持久性的贡献。
回答这些问题需要付出很大的努力。可能就像达利用他标志性的超现实主义风格来描绘记忆及其不稳定性一样,约瓦舍维奇等人发现的这簇神经元还需要充分的架构,以支持记忆的持续和解体。
参考文献:
[1] Josselyn SA, Köhler S, Frankland PW. Heroes of the Engram. J Neurosci. 2017;37(18):4647-4657. doi:10.1523/JNEUROSCI.0056-17.2017
[2] Tonegawa S, Liu X, Ramirez S, Redondo R. Memory Engram Cells Have Come of Age. Neuron. 2015;87(5):918-931. doi:10.1016/j.neuron.2015.08.002
[3] Kelvington BA, Abel T. Innate immunity in neurons makes memories persist. Nature. 2024;628(8006):40-42. doi:10.1038/d41586-024-00679-4
[4] Madabhushi R, Gao F, Pfenning AR, et al. Activity-Induced DNA Breaks Govern the Expression of Neuronal Early-Response Genes. Cell. 2015;161(7):1592-1605. doi:10.1016/j.cell.2015.05.032
[5] Weber Boutros, S.; Unni, V.K.; Raber, J. An Adaptive Role for DNA Double-Strand Breaks in Hippocampus-Dependent Learning and Memory. Int. J. Mol. Sci. 2022, 23, 8352. https://doi.org/10.3390/ijms23158352
[6] Weber Boutros, S.; Unni, V.K.; Raber, J. An Adaptive Role for DNA Double-Strand Breaks in Hippocampus-Dependent Learning and Memory. Int. J. Mol. Sci. 2022, 23, 8352. https://doi.org/10.3390/ijms23158352
[7] Shomrat T, Levin M. An automated training paradigm reveals long-term memory in planarians and its persistence through head regeneration. J Exp Biol. 2013;216(Pt 20):3799-3810. doi:10.1242/jeb.087809
[8] Dias BG, Ressler KJ. Parental olfactory experience influences behavior and neural structure in subsequent generations. Nat Neurosci. 2014;17(1):89-96. doi:10.1038/nn.3594
本文来自微信公众号:追问nextquestion (ID:gh_2414d982daee),作者:执盈,审校&编辑:存源
相关推荐
我们的记忆,源于DNA瓦解?
贝索斯的思想DNA
记忆是如何欺骗我们的?
那位相信“水有记忆”的诺奖得主,究竟做了什么伪科学?
我,就是数据:高中生把数据编入体内,1公斤DNA 未来可储存全球数据
是什么让我们成为人类?答案就在“垃圾DNA”中
把DNA换成RNA,有望创造强大、可持续的生物计算机
奇怪的DNA
美式“铁饭碗”的瓦解
如果互联网真是有记忆的,这些记忆可以分为哪几种类型?
网址: 我们的记忆,源于DNA瓦解? http://www.xishuta.com/newsview117544.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95792
- 2报告:抖音海外版下载量突破1 25736
- 3人类唯一的出路:变成人工智能 25175
- 4人类唯一的出路: 变成人工智 24611
- 5移动办公如何高效?谷歌研究了 24309
- 6华为 nova14深度评测: 13155
- 7滴滴出行被投诉价格操纵,网约 11888
- 82023年起,银行存取款迎来 10774
- 9五一来了,大数据杀熟又想来, 9794
- 10手机中存在一个监听开关,你关 9519