你怎么这么爱脑补?
本文来自微信公众号:神经现实(ID:neureality),作者:eLife,编译:Orange Soda,题图来自:电影《阿丽塔:战斗天使》
视觉表象
你身边有没有一个爱脑补的小伙伴?三言两语的描述就能让他/她脑补出一部电视剧。这种将实际上看不见的事物在精神上具象化的能力叫做“视觉表象”(visual imagery),又被形象地称为“心灵之眼所见”(see with the mind’s eye)。
产生视觉表象的神经机制是怎样的?为了回答这一问题,很多研究者将目光集中在视觉表象与视知觉二者的相似性上。研究证据表明枕叶、顶叶和额叶皮层多个区域组成的的大型网络参与了产生视觉表象的过程(Pearson et al., 2015b;Dijkstra et al., 2019),并且最近的研究结果显示,视觉表象的内容与早期视觉皮层的活动相关,这意味着与视觉表象相关的神经加工过程和视知觉加工过程可能存在重叠(Albers et al., 2013; Thirion et al., 2006; Cui et al., 2007)。尽管存在一些相似性,视觉表象又明显地区别于视知觉:前者是由内在驱动的表征,而后者是由外在驱动的表征。
数十年来,认知科学、哲学、神经科学和人工智能等领域的科学家们就“大脑如何进行内在表征”这一问题争论不休,一种观点是视觉信息的内在表征仅仅是描述性的(depictive,呈语言形式的),另一种观点则是这种内在表征也可以是具象化的(pictorial,呈图象形式的)。目前一个被普遍接受的观点是这两种表征形式在我们的大脑内同时存在。
个体差异
与那些经常感叹“我有画面感了”的人相反,另外一些人从来不幻想。研究者用“想象障碍”(aphantasia)来形容这一从来不会产生视觉表象的群体(Zeman et al., 2015)。不同人的想象力之间似乎有很大的差异。这样的差异不仅存在于主观报告中(Galton, 1883),也存在于对视觉表象的客观测量中(Keogh & Pearson,2018)。
极少数的研究试图深入探讨究竟是什么导致了视觉表象能力如此大的个体差异性。一项研究报告说视觉表象的生动性(vividness)与视皮层的BOLD*[1]信号变化正相关(Cui et al., 2007)。另外有研究记录了被试在产生视觉表象与视知觉过程中,早期视皮层BOLD信号的相似性,发现这一相似性与视觉表象的生动性有关(Lee et al., 2012;Dijkstra et al., 2017)。
这些先前研究表明,视皮层活动与视觉表象的生动性之间存在关联,但它们并未解释为什么一些人更善于利用早期视皮层来完成生动的视觉表象。
在最新一份研究中,基奥(Keogh)等人对于视觉表象的另一特征,即视觉表象的强度(strength)的个体差异性进行了研究,发现皮层的兴奋性可能是造成这种个体差异的原因。利用fMRI(functional magnetic resonance imaging,功能磁共振成像)和TMS(transcranial magnetic stimulation,经颅磁刺激),研究者发现视皮层兴奋性越低,额叶皮层兴奋性就越高,被试的视觉表象也就越强。另外,研究者还利tDCS(transcranial direct-current stimulation,经颅直流电刺激)进行了干预实验,揭示了皮层兴奋性与视觉表象强度之间的因果关系。
译者注:[1] BOLD:血氧浓度依赖性 (Blood Oxygen Level-Dependent),fMRI正是一种利用BOLD信号成像的技术。具体来说,因为神经活动需要耗氧,因此监测皮层某区域的含氧血红蛋白和脱氧血红蛋白的浓度变化可以间接反映相应区域的神经活动。fMRI技术利用的是含氧血红蛋白和脱氧血红蛋白二者对磁场的反应不同(含氧血红蛋白具有反磁性,脱氧血红蛋白具有顺磁性)这一原理来反映所监测脑区的神经活动。
实验中采用双眼竞争表象范式(binocular rivalry imagery paradigm)*[2]来测量视觉表象的强度(Figure 1),在此之前的研究表明这一方法可以很好地测量精神表象的强度(Pearson, 2014)。当被试想象着某一视觉刺激,这一视觉表象过程会影响到被试在接下来进行的一段双眼竞争实验中的知觉,即他们会更加倾向于知觉到产生过视觉表象的那个刺激(Pearson et al., 2015b)。更长时间的表象过程会增加在接下来的双眼竞争中相应的刺激的知觉启动*[3](perceptual priming)。
译者注:[2] 双眼竞争实验是给被试的左眼和右眼呈现不同的刺激,这样的实验设计会使得被试一会知觉到左眼的刺激,一会知觉到右眼的刺激,并且知觉不自觉地一直在两种刺激之间切换。双眼竞争现象会受到诸多因素影响,在当前的实验中,被试对某一刺激预先生成了视觉表象,这一过程使得该刺激更可能在接下来的双眼竞争中更占优势。
[3] 启动效应(priming effect)是指由于之前呈现的某一刺激而使得之后而影响到对同一刺激或者相关刺激的知觉和加工过程的心理现象。例如给被试一个线索词“太阳”,当后续呈现的词语是“月亮”时的反应时会短于“章鱼”。

双眼竞争表象范式
实验流程按照“呈现线索-产生视觉表象-双眼竞争-反应记录”来进行。实验中,被试首先会看到字母R(代表红色水平朝向刺激)或字母G(代表绿色垂直朝向刺激),根据线索产生视觉表象后接着进行短暂的双眼竞争实验,最后按键选择在双眼竞争中占领知觉优势的刺激(“1”代表大多数时间知觉到绿色,“2”代表二者混合,“3”代表大多数时间知觉到红色)。
在这项研究中,研究者采用了两种方法来测量皮层的兴奋性。
一种方法是记录被试在静息态(resting-state,被试处于清醒但无任务的状态)的fMRI数据,采用全脑表面组分析(whole-brain surface-based analysis)的方法来得到归一化的皮层兴奋性数据。结果表明,测量得到的被试的视觉表象强度越高,视皮层x越高,视皮层兴奋性越低,而额叶皮层的兴奋性越高。
研究者另外还采用了TMS的方法来测量被试的光幻视阈值(phosphene threshold, PT)。具体来说,对视皮层进行TMS会产生微弱的视觉幻觉,通过测量产生这种视觉幻觉所需要的磁场强度就可以间接反映皮层的兴奋性。采用这一方法所得到的结论与由fMRI数据分析得到的结果一致。
此前的研究表明额叶皮层和视皮层可能会在一些知觉过程中起到联合作用(Østby et al., 2012;Schlegel et al., 2013),但这份研究的结果表明将二者的功能连接强度考虑在内并不能更好地预测视觉表象的强度;即决定被试的视觉表象强度的因素是额叶皮层具有越高的兴奋性和视皮层具有越低的兴奋性的被试,而不是这个区域之间的时程耦合。

被试静息态皮层兴奋性与视觉表象强度的相关关系
(A)fMRI数据的全脑表面组分析结果。上排左右分别代表外侧(lateral)视角的左右半脑,下排左右分别代表内侧(medial)视角的左右半脑。红色代表正相关,蓝色代表正相关。枕叶皮层(视皮层所在区域)的兴奋性与视觉表象强度呈负相关,而额叶皮层的兴奋性与视觉表象强度呈正相关。
(B)TMS方法测量被试光幻视阈值的分析结果。光幻视阈值的倒数(与皮层兴奋性呈正比)与视觉表象强度呈反相关。
建立因果关系
然而,仅仅通过建立皮层兴奋性与被试的视觉表象强度的相关关系还不能确定二者之间是否存在因果关系。因此,研究者进一步采用tDCS技术展开了干预实验,通过控制tDCS的电极极性和位置来增强或减弱皮层的兴奋性(Filmer et al., 2014)。简单来说,将阴极电极放置在某个皮层区域上方时,该区域的皮层兴奋性会降低,反之放置阳极电极则可以增强皮层的兴奋性(虽然不同电极的效果可能受到很多方法上的和个体差异的影响,Strube et al., 2016;Filmer et al., 2019a;Batsikadze et al., 2013;Monte-Silva et al., 2013)。
为了避免阴极刺激和阳极刺激发生相互干扰,实验被试分别在两天接受两种不同电极的刺激(相隔至少24hr)。进一步可以比较不同条件的tDCS对视觉表象强度的影响。
结果发现,当采用1.5mA的阴极刺激来减弱视皮层的兴奋性时,或者采用1.5mA的阳极刺激来增强额叶皮层的兴奋性时,可以观察到视觉表象强度得到了提升。但有趣地是,当采用同样的刺激条件用阴极刺激减弱视皮层兴奋性,同时采用阳极刺激来增强额叶皮层兴奋性时,被试的视觉表象强度并未发生显著性变化。
对这一结果的一个有可能的解释是,同时刺激两个区域使得其他一些区域的活动也受到了影响,因此最终的刺激效果被中和(Bikson et al., 2010)或者使得实际起作用的电流密度不足。
总结与讨论
这篇研究所报告的实验结果揭示了皮层兴奋性可能会影响视觉表象的强度,具体来说,视觉表象的强度与视皮层兴奋性呈负相关而与额叶皮层兴奋性呈正相关。而个体之间存在的皮层兴奋性差异正可以作为视觉表象个体差异的一种可能解释。
从分子层面来看,这种视皮层兴奋性的个体差异可能来源于兴奋性和抑制性神经递质浓度的差异:实验结果表明早期视皮层的谷氨酸浓度与皮层兴奋性呈正比(Terhune et al., 2015b),而GABA(γ-氨基丁酸)的影响则还不明确(Terhune et al., 2016b;Boillat et al., 2020)。
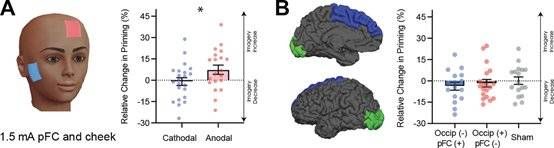
tDCS干预实验结果示例
(A)左:单独对额叶皮层进行tDCS,电流1.5mA,有效电极位于左脑额叶,参考电极位于右侧脸颊,刺激时间15min。右:当采用正极电极刺激额叶皮层时(统计图中红色),视觉表象强度得到了增强。(B)同时对额叶皮层和视皮层进行tDCS,参数同上。左:实验中具体的刺激位置。右:同时刺激前额叶皮层和枕叶皮层,不论电极的极性,视觉表象强度没有显著性变化(统计图中蓝色和红色),与对照组(统计图中灰色,实验中tDCS机器刺激30s后停止)没有显著差异。
来自LISA CLARK
至于为什么皮层的兴奋性会影响到视觉表象的强度,作者认为皮层兴奋性的改变实际上造成的是神经信号的信噪比(signal-noise ratio,SNR)。我们可以将神经活动理解为信号加上噪声,通常来说神经信号是指某一群神经元通过提高发放率来对特定刺激编码,而噪声指的是其他无关的神经元活动。更高的信噪比可以带来更好的行为表现,而改变皮层兴奋性可能正是改变了这种信噪比。
通过增加发放或者调节神经群体活动,额叶皮层更高的兴奋性得到提高从而使得自上而下的信号能够被放大;而自上而下信号的增强更好地抑制了低层级脑区内和信号无关的神经信号,从而提高了视皮层的信噪比。
这篇研究所得出的结果,看上去和此前研究视觉表象的研究结果似乎存在着矛盾。例如,有研究报告了视皮层活动与视觉表象生动性的正相关(Cui et al., 2007;Amedi et al., 2005;Cattaneo et al., 2011;Sparing et al., 2002)。
但这些研究的实验测量的往往是事件相关(event-related)的神经活动或是分析静息态的视皮层兴奋性对任务表现的影响。那么很有可能在这些任务中,被试平均的神经活动随着表象强度的增加而增加,而在那些静息态具有最低水平视皮层兴奋性的被试身上,测得了最大的神经活动的变化。
局限性及未来研究方向
值得注意的是,在实验中虽然大部分的被试的数据表现出相同的规律,但有一部分的被试表现出相反的结果。在之前的一些研究中也发现了tDCS产生的效果因人而异(Chew et al., 2015;Lo´pez-Alonso et al., 2014),有时甚至对兴奋性的改变方向(增强或减弱)都可能不同(Strube et al., 2016)。
另一方面,并不能完全排除的是tDCS的刺激实际上是促进了实验任务中包括的其他的认知过程,例如持续性注意或选择性注意。另外,在考虑这项研究中得出的结论时,要特别地考虑到实验中具体采用的实验范式和实验参数。目前实验中测量的仅仅是视觉表象的强度,但视觉表象还表现出其他一些特征,例如生动性、容量和准确性(Keogh & Pearson, 2017; Pearson et al., 2011; Bergmann et al., 2016a);尽管视觉表象的强度和生动性之间存在关联,但是目前还没有证据证明皮层兴奋性对其他这些特征的影响。
另外,实验中采用的视觉刺激时简单的红绿Gabor刺激(正弦函数与高斯函数卷积生成的一种刺激),这种刺激非常适合激活早期视皮层;而如果采用更复杂的刺激,例如人脸刺激,则相比于早期视皮层,更有可能在例如梭状回面孔区(fusiform face area)这样更高级的脑区观察到更强的表征。
对于不同的视觉刺激来说,一种可能的表征机制是:提高额叶皮层的兴奋性可以增强自上而下的信号强度,从而可以增强所有类型的视觉表象;但只有那些需要激活底层级感觉特征(例如颜色或者朝向)的视觉表象才会受到视皮层兴奋性的影响。
当前的研究结果也给一些精神障碍的治疗也提供了思路:在一些情况下,患者的表象可能不受控制,例如,精神分裂症和帕金森,而且这两种疾病的患者被报告具有更生动的精神表象(Shine et al., 2015;Sack et al., 2005);
而在另一些情况下,表象则可以用来治疗疾病(Pearson et al., 2015b),一些研究表明具有精神病倾向的个体的自上而下的信号强于自下而上的信号(Teufel et al., 2015),采用非侵入性的神经干预治疗方法也许可以帮助患者调整自上而下/自下而上信号之间的平衡。未来更多的工作需要探究能够带来更长期效果的刺激方案,并且充分考虑到干预手段的效果的个体差异。
参考文献
1. Albers AM, Kok P, Toni I, Dijkerman HC, de Lange FP. 2013. Shared representations for working memory and mental imagery in early visual cortex. Current Biology 23:1427–1431. DOI: https://doi.org/10.1016/j.cub.2013. 05.065, PMID: 23871239
2. Amedi A, Malach R, Pascual-Leone A. 2005. Negative BOLD differentiates visual imagery and perception.Neuron 48:859–872. DOI: https://doi.org/10.1016/j.neuron.2005.10.032, PMID: 16337922
3. Batsikadze G, Moliadze V, Paulus W, Kuo MF, Nitsche MA. 2013. Partially non-linear stimulation intensitydependent effects of direct current stimulation on motor cortex excitability in humans. The Journal of Physiology 591:1987–2000. DOI:https://doi.org/10.1113/jphysiol.2012.249730, PMID: 23339180
4. Bergmann J, Genc¸ E, Kohler A, Singer W, Pearson J. 2016a. Smaller primary visual cortex is associated with stronger, but less precise mental imagery. Cerebral Cortex 26:3838–3850. DOI: https://doi.org/10.1093/cercor/ bhv186, PMID: 26286919
5. Bikson M, Datta A, Rahman A, Scaturro J. 2010. Electrode montages for tDCS and weak transcranial electrical stimulation: role of "return" electrode’s position and size. Clinical Neurophysiology 121:1976–1978.DOI: https://doi.org/10.1016/j.clinph.2010.05.020, PMID: 21035740
6. Boillat Y, Xin L, van der Zwaag W, Gruetter R. 2020. Metabolite concentration changes associated with positive and negative BOLD responses in the human visual cortex: a functional MRS study at 7 tesla. Journal of Cerebral Blood Flow & Metabolism 40:488–500. DOI: https://doi.org/10.1177/0271678X19831022, PMID: 30755134
7. Cattaneo Z, Pisoni A, Papagno C, Silvanto J. 2011. Modulation of visual cortical excitability by working memory: effect of luminance contrast of mental imagery. Frontiers in Psychology 2:29. DOI: https://doi.org/10.3389/ fpsyg.2011.00029, PMID: 21713175
8. Chew T, Ho KA, Loo CK. 2015. Inter- and Intra-individual variability in response to transcranial direct current stimulation (tDCS) at varying current intensities. Brain Stimulation 8:1130–1137. DOI: https://doi.org/10.1016/j. brs.2015.07.031, PMID: 26294061
9. Cui X, Jeter CB, Yang D, Montague PR, Eagleman DM. 2007. Vividness of mental imagery: individual variability can be measured objectively. Vision Research 47:474–478. DOI: https://doi.org/10.1016/j.visres.2006.11.013,PMID: 17239915
10.Dijkstra N, Bosch SE, van Gerven MAJ. 2019. Shared neural mechanisms of visual perception and imagery.Trends in Cognitive Sciences 23:423–434. DOI: https://doi.org/10.1016/j.tics.2019.02.004, PMID: 30876729
11.Dijkstra N, Bosch SE, van Gerven MA. 2017. Vividness of visual imagery depends on the neural overlap with perception in visual Areas. The Journal of Neuroscience 37:1367–1373. DOI: https://doi.org/10.1523/ JNEUROSCI.3022-16.2016, PMID: 28073940
12. Filmer HL, Dux PE, Mattingley JB. 2014. Applications of transcranial direct current stimulation for understanding brain function. Trends in Neurosciences 37:742–753. DOI: https://doi.org/10.1016/j.tins.2014.08.003,PMID: 25189102
13. Filmer HL, Ehrhardt SE, Shaw TB, Mattingley JB, Dux PE. 2019a. The efficacy of transcranial direct current stimulation to prefrontal Areas is related to underlying cortical morphology. NeuroImage 196:41–48.DOI: https://doi.org/10.1016/j.neuroimage.2019.04.026, PMID: 30978491
14. Galton F. 1883. Inquiries Into Human Faculty and Its Development. Macmillan.
15. Keogh R, Pearson J. 2018. The blind mind: no sensory visual imagery in aphantasia. Cortex 105:53–60.DOI: https://doi.org/10.1016/j.cortex.2017.10.012, PMID: 29175093
16. Keogh R, Pearson J. 2017. The perceptual and phenomenal capacity of mental imagery. Cognition 162:124–132.DOI: https://doi.org/10.1016/j.cognition.2017.02.004, PMID: 28235663
17. Lee SH, Kravitz DJ, Baker CI. 2012. Disentangling visual imagery and perception of real-world objects.NeuroImage 59:4064–4073. DOI: https://doi.org/10.1016/j.neuroimage.2011.10.055, PMID: 22040738
18. Lo´ pez-Alonso V, Cheeran B, Rı´o-Rodrı´guez D, Ferna´ndez-Del-Olmo M. 2014. Inter-individual variability in response to non-invasive brain stimulation paradigms. Brain Stimulation 7:372–380. DOI: https://doi.org/10. 1016/j.brs.2014.02.004, PMID: 24630849
19. Monte-Silva K, Kuo MF, Hessenthaler S, Fresnoza S, Liebetanz D, Paulus W, Nitsche MA. 2013. Induction of late LTP-like plasticity in the human motor cortex by repeated non-invasive brain stimulation. Brain Stimulation 6: 424–432. DOI: https://doi.org/10.1016/j.brs.2012.04.011, PMID: 22695026
20. Østby Y, Walhovd KB, Tamnes CK, Grydeland H, Westlye LT, Fjell AM. 2012. Mental time travel and defaultmode network functional connectivity in the developing brain. PNAS 109:16800–16804. DOI: https://doi.org/ 10.1073/pnas.1210627109, PMID: 23027942
21. Pearson J, Naselaris T, Holmes EA, Kosslyn SM. 2015b. Mental imagery: functional mechanisms and clinical applications. Trends in Cognitive Sciences 19:590–602. DOI: https://doi.org/10.1016/j.tics.2015.08.003,PMID: 26412097
22. Pearson J. 2014. New directions in Mental-Imagery research: the Binocular-Rivalry technique and decoding fMRI patterns. Current Directions in Psychological Science 23:178–183. DOI: https://doi.org/10.1177/ 0963721414532287
23. Pearson J, Rademaker RL, Tong F. 2011. Evaluating the mind’s eye: the metacognition of visual imagery.Psychological Science 22:1535–1542. DOI: https://doi.org/10.1177/0956797611417134, PMID: 22058106
24. Pearson J, Naselaris T, Holmes EA, Kosslyn SM. 2015b. Mental imagery: functional mechanisms and clinical applications. Trends in Cognitive Sciences 19:590–602. DOI: https://doi.org/10.1016/j.tics.2015.08.003,PMID: 26412097
25. Sack AT, van de Ven VG, Etschenberg S, Schatz D, Linden DE. 2005. Enhanced vividness of mental imagery as a trait marker of schizophrenia? Schizophrenia Bulletin 31:97–104. DOI: https://doi.org/10.1093/schbul/sbi011,PMID: 15888429
26. Schlegel A, Kohler PJ, Fogelson SV, Alexander P, Konuthula D, Tse PU. 2013. Network structure and dynamics of the mental workspace. PNAS 110:16277–16282. DOI: https://doi.org/10.1073/pnas.1311149110, PMID: 24043 842
27. Sparing R, Mottaghy FM, Ganis G, Thompson WL, To¨ pper R, Kosslyn SM, Pascual-Leone A. 2002. Visual cortex excitability increases during visual mental imagery–a TMS study in healthy human subjects. Brain Research 938: 92–97. DOI: https://doi.org/10.1016/S0006-8993(02)02478-2, PMID: 12031540
28. Shine JM, Keogh R, O’Callaghan C, Muller AJ, Lewis SJG, Pearson J. 2015. Imagine that: elevated sensory strength of mental imagery in individuals with Parkinson’s disease and visual hallucinations. Proceedings of the Royal Society B: Biological Sciences 282:20142047. DOI: https://doi.org/10.1098/rspb.2014.2047
29. Strube W, Bunse T, Nitsche MA, Nikolaeva A, Palm U, Padberg F, Falkai P, Hasan A. 2016. Bidirectional variability in motor cortex excitability modulation following 1 mA transcranial direct current stimulation in healthy participants. Physiological Reports 4:e12884. DOI: https://doi.org/10.14814/phy2.12884, PMID: 274952 98
30. Terhune DB, Murray E, Near J, Stagg CJ, Cowey A, Cohen Kadosh R. 2015b. Phosphene perception relates to visual cortex glutamate levels and covaries with atypical visuospatial awareness. Cerebral Cortex 25:4341–4350.DOI: https://doi.org/10.1093/cercor/bhv015, PMID: 25725043
31. Teufel C, Subramaniam N, Dobler V, Perez J, Finnemann J, Mehta PR, Goodyer IM, Fletcher PC. 2015. Shift toward prior knowledge confers a perceptual advantage in early psychosis and psychosis-prone healthy individuals. PNAS 112:13401–13406. DOI: https://doi.org/10.1073/pnas.1503916112, PMID: 26460044
32. Thirion B, Duchesnay E, Hubbard E, Dubois J, Poline JB, Lebihan D, Dehaene S. 2006. Inverse retinotopy: inferring the visual content of images from brain activation patterns. NeuroImage 33:1104–1116. DOI: https:// doi.org/10.1016/j.neuroimage.2006.06.062, PMID: 17029988
33. Zeman A, Dewar M, Della Sala S. 2015. Lives without imagery - Congenital aphantasia. Cortex 73:378–380.DOI: https://doi.org/10.1016/j.cortex.2015.05.019, PMID: 26115582
编译来源:Rebecca Keogh, Johanna Bergmann, Joel Pearson. Cortical excitability controls the strength of mental imagery. eLife. DOI: https://doi.org/10.7554/eLife.50232
本文来自微信公众号:神经现实(ID:neureality),作者:eLife,编译:Orange Soda
相关推荐
你怎么这么爱脑补?
如果科技能够让你变“超脑”,你愿意尝试吗?
最新研究说对着屏幕伤眼伤脑还加速衰老,可是你舍得放下手机吗
智能手机怎么变得这么无聊了?
怎么夸马斯克都不为过,但不好意思,“脑机接口”离让你永生还远着呢
全球航旅市场进入速冻模式,“千亿美元天坑”怎么补?|超级观点
马斯克的“脑机接口”,太“神话”了?
让一群脑洞清奇的开发者告诉你,AI+产业的N种可能
Model 3车门再被冻住,你得这么整
MIT脑洞研究:只听6秒语音,AI就知道你长什么样
网址: 你怎么这么爱脑补? http://www.xishuta.com/newsview25425.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95792
- 2报告:抖音海外版下载量突破1 25736
- 3人类唯一的出路:变成人工智能 25175
- 4人类唯一的出路: 变成人工智 24611
- 5移动办公如何高效?谷歌研究了 24309
- 6华为 nova14深度评测: 13155
- 7滴滴出行被投诉价格操纵,网约 11888
- 82023年起,银行存取款迎来 10774
- 9五一来了,大数据杀熟又想来, 9794
- 10手机中存在一个监听开关,你关 9519