全球多地正式开始接种,200余项新冠疫苗正在研发,药企聚力阻击新冠疫情 | 2020盘点
中国已于2021年1月启动一场全国性的新冠疫苗接种行动,各地累计报告新冠疫苗接种数量超过2400万剂次。除了呼吁国民接种疫苗外,中方还决定助力于“新冠疫苗实施计划”(COVAX),于近日向巴基斯坦、叙利亚等发展中国家提供新冠疫苗。
非盟轮值主席,南非总统拉马福萨于2月6日在非盟虚拟会议上透露,非洲大陆目前已经通过世界卫生组织、非盟等渠道筹措了10亿支新冠肺炎疫苗。中东多国正积极推进疫苗接种工作,以色列卫生部也于6日表示,目前该国已对累计逾341万人进行了疫苗接种,占全国总人口的36.7%。
自疫情开始,新冠疫苗就牵动全球人心。
日前,国内外新冠疫苗接连传来喜讯:国内康希诺生物发布公告称,与陈薇院士团队合作研发的腺病毒载体疫苗可继续推进三期临床试验;哥伦比亚、新西兰、巴基斯坦、迪拜等地陆续批准新冠疫苗,或正式开始接种。
与病毒竞争速度,疫苗的进展也并不容乐观:2月3日,据外媒报道,英国的变种新冠病毒正发生新突变,与此前发现的南非和巴西变种相似,多款疫苗面对变异新冠病毒有效率降低;而在今年1月底,继美国公司辉瑞表示无法按时交付疫苗后,英国药企阿斯利康也告知欧盟,其第一季度的供货数量或将削减60%,多国担忧新冠疫苗供应不足。
2020年年初,新冠肺炎疫情爆发,全球打响疫情防控阻击战。截至目前,全球累计确诊人数超1亿,累计死亡人数224万。在全球医疗科研机构与企业的共同努力下,一年以来,新冠疫苗研发工作取得了巨大的进展,多个国家和地区陆续开始疫苗的接种工作。
截至2021年1月19日,WHO新冠疫苗进展草图显示目前处于临床前阶段的新冠疫苗为173项,进入临床试验为64项,其中2/3期和3期临床试验共22项。新冠疫苗研发的传统技术路径是灭活、减毒和蛋白重组技术,而近年来兴起的病毒载体疫苗、核酸疫苗(mRNA疫苗和DNA疫苗)等新技术平台为新冠疫苗研发开辟了新的方向。[1]
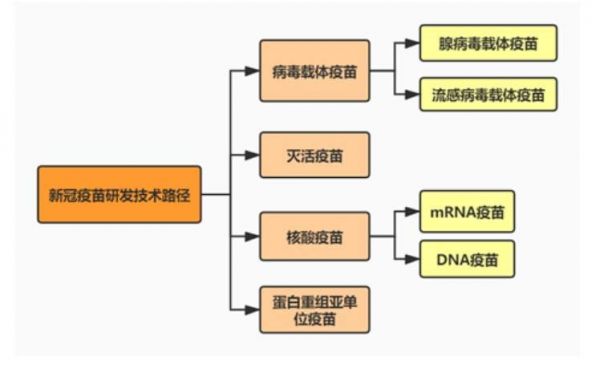
新冠疫苗研发路径[1]
目前,全球疫苗主要分为灭活病毒疫苗、病毒载体疫苗、重组蛋白疫苗和核酸(DNA与RNA)疫苗几种技术路径。灭活疫苗制备方式最为传统经典,是一种成熟、可靠的研发手段,然而其产生的免疫相对较弱;核酸疫苗生产迅速,具有很大的时效性,可针对流行病做出快速反应,但具有很多的不确定性,对运输和储藏条件要求相对苛刻;亚单位疫苗(重组蛋白)技术成熟,更加安全,引起不良反应的可能性极小,但引起的免疫反应也可能不够强烈;腺病毒载体疫苗相对安全,存储方便,其缺点在于“预存免疫”可能攻击载体,从而降低疫苗效果。
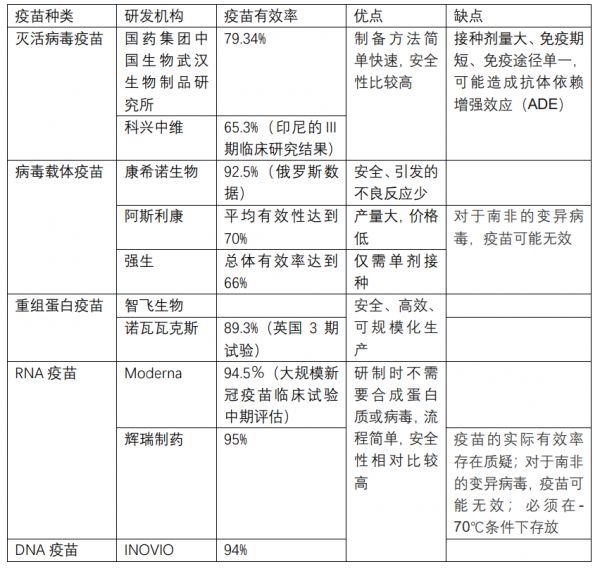
国内外部分新冠疫苗比较
灭活病毒疫苗
国药集团中国生物武汉生物制品研究所
2020年4月12日,由国药集团中国生物武汉生物制品研究所申报的新型冠状病毒灭活疫苗,获得国家药品监督管理局临床试验许可。该疫苗从启动研发到获批临床只用了98天,成为全球首家获得临床试验批件的新冠病毒灭活疫苗。
国药集团中国生物在国内I/Ⅱ期临床研究和海外Ⅲ期临床研究中都进行了抗体的持久性观察,6个月以上观察数据显示抗体仍维持在较高水平上。III期临床全球志愿者入组超过60000人,样本人群覆盖125个国籍,从III期临床试验入组启动到附条件获批上市,仅用了168天。
2020年12月30日,国家药品监管局附条件批准国药集团中国生物新冠灭活疫苗(Vero 细胞)注册申请。该疫苗是首家获批的国产新冠病毒灭活疫苗。已有数据显示,该疫苗保护率为79.34%,实现安全性、有效性、可及性、可负担性的统一。
→中国新冠疫苗上市!独家披露央企研发新冠灭活疫苗历程
科兴中维
截至2020年1月10日,北京科兴中维生物技术有限公司的新冠灭活疫苗“克尔来福”已有超700万剂供应到国内各省,并与香港政府签署了100万剂供应协议。
据悉,新冠灭活疫苗“克尔来福”已在去年4月进入Ⅰ期和Ⅱ期临床研究,证实了疫苗的安全和有效性。之后分别在巴西、土耳其、印尼以及智利等国开始Ⅲ期临床研究。
临床研究在不同国家采用的是相同的新冠疫苗,为同一批次,总体上的评价至今已完成24400名志愿者的入组。土耳其的中期分析保护率能达到91.25%,印尼的Ⅲ期临床研究结果保护率65.3%。巴西的Ⅲ期临床研究结果显示,疫苗对重症和住院的保护率达到百分之百,对于就医(志愿者得病之后去医院看病)的保护率达到78%。对于高危人群医护人员的保护率总体上也达到了50.3%。
→北京科兴中维:超700万剂灭活疫苗已供应各省
病毒载体疫苗
康希诺生物
康希诺生物于2021年2月1日发布公告称,公司已完成重组腺病毒5型载体新冠疫苗(Ad5-nCoV)的III期临床试验中期分析的病例累积,相关数据已提交独立数据监察委员会(IDMC)。康希诺生物表示,公司已接到IDMC的通知,在本次中期分析中,腺病毒载体新冠疫疫苗成功达到预设的主要安全性及有效性标准,无任何与疫苗相关的严重不良事件(SAE)发生,公司可继续推进该新冠疫苗的III期临床试验。
Ad5-nCoV的III期临床试验的信息 Ad5-nCoV的III期临床试验为一项全球多中心、随机、双盲、安慰剂对照、适应性试验,已在三个大洲五个国家的78家临床研究中心完成对4万余受试者的接种,旨在评估 Ad5-nCoV疫苗在18岁及以上健康成年人中的有效性、安全性和免疫原性。
→康希诺:逾4万人接种新冠疫苗,主要安全性及有效性标准达标
阿斯利康
2020年11月23日,阿斯利康宣布其与牛津大学合作新冠疫苗AZD1222对新冠病毒有效,平均有效性达到70%,其中一个半剂量的有效率90%,两剂量70%。阿斯利康首席执行官帕斯卡尔·索里奥特(Pascal Soriot)表示,阿斯利康新冠肺炎疫苗在2020年底投产,并将扩大生产,以确保从2021年1月开始正式上市。
越南卫生部副部长张国强于2021年2月1日签发关于有条件批准新冠肺炎疫苗(阿斯利康疫苗)可在紧急情况下使用的第983号决定。南非当地时间2021年2月1日下午,由印度血清研究所生产的100万剂阿斯利康疫苗如期从印度孟买运抵南非约翰内斯堡奥·坦博国际机场,这是自2020年3月5日南非发现首例新冠肺炎确诊病例以来,南非收到的首批新冠肺炎疫苗。
→瑞典新冠肺炎疫苗来了,阿斯利康启动中国临床试验
强生
美国时间2021年1月29日,强生宣布其在研单剂新冠疫苗(JNJ-78436735)在代号为ENSEMBLE的III期临床研究中达到所有主要临床终点和关键次要终点,并计划于2月初向FDA提交紧急使用授权申请。
与其他疫苗不同的是,强生的单剂新冠疫苗仅需接种一次。单次接种28天后,该款疫苗预防中、重度COVID-19的总体有效率达到66%。值得注意的是,不同地区保护效力有所不同,美国为72%,拉丁美洲为66%,南非为57%。在安全性方面,对不良事件的回顾表明,疫苗耐受性良好。
→强生新冠疫苗III期研究成功,计划2月初申请紧急使用授权
重组蛋白疫苗
智飞生物
2020年6月23日,智飞生物发布公告,公司全资子公司安徽智飞龙科马生物制药有限公司与中国科学院微生物研究所合作研发的重组新型冠状病毒疫苗(CHO细胞)获批临床试验,该批件有效期为12个月。
2020年12月10日,智飞生物重组新冠疫苗在乌兹别克斯坦启动国际临床Ⅲ期试验。
→智飞生物新冠疫苗获临床批件!成史上第三只百元渝股,总市值达1648亿元
诺瓦瓦克斯
当地时间2021年1月28日,美国疫苗公司诺瓦瓦克斯(Novavax)公司宣布了新冠肺炎疫苗在英国3期试验的临床数据,该疫苗总体保护力为89.3%,在英国进行的试验包括基于对56例Covid-19病例进行的PCR试验得出的菌株效力评估,发现该疫苗对最初的新冠病毒有95.6%的效力,对在英国首次发现的称为B.1.1.7的变种有85.6%的效力。在南非,Novavax疫苗在研究中对新冠病毒的有效性约为49.4%。
→Novavax新冠疫苗三期临床数据发布:有效率达89.3% 对英国和南非变种病毒有效
RNA疫苗
Moderna
2020年2月,美国制药公司Moderna就已成功研制出针对新冠病毒肺炎——SARS-CoV-2的人体疫苗,并已将第一批疫苗送美国国家卫生研究院开启安全性临床试验。
Moderna在2020年12月初称,预计2020年年底之前可在美国供应2000万剂量的新冠肺炎疫苗。在第一阶段试验中,受试对象在(接种疫苗的)119天之后保持高水平的抗体。
→Moderna:公司新冠肺炎疫苗具备持久免疫的潜质
辉瑞制药
辉瑞及其合作伙伴BioNTech在2020年11月10日发布消息称,新冠肺炎候选疫苗BNT162b2在没有感染过新冠病毒的参与者身上,已经展现出强大的有效性,预防新冠肺炎的有效性超过90%。
BNT162b2疫苗,它含有一段经优化的新冠病毒全长刺突糖蛋白mRNA。新冠病毒的刺突蛋白是新冠病毒与人体细胞表面ACE2受体结合,进而入侵细胞的关键。因此从理论上讲,BNT162b2在人体内诱导的中和抗体,可以阻止新冠病毒感染人体细胞。BNT162b2的III期临床试验始于今年的7月份,目前已招募了43538例没有感染过新冠病毒的参与者。其中包括约42%的全球参与者和30%的美国参与者。
然而目前对辉瑞疫苗存在诸多质疑,流行病家 Peter Doshi于1月4日发表的文章中称疫苗的实际有效率可能仅有 19%~29%,此外也有研究报道辉瑞疫苗对新冠变异毒株存效力下降风险。
→新冠疫苗重大突破!辉瑞刚刚发布新冠疫苗三期临床试验中期数据,宣布其疫苗预防新冠肺炎的有效性超过90%丨临床大发现
DNA疫苗
INOVIO
INOVIO(NASDAQ:INO)生物技术公司于2020年11月18日宣布,已获得美国食品药品监督管理局(FDA)的许可,可继续进行计划中的INO-4800(其候选新冠肺炎疫苗)2/3期临床试验的2期阶段。
INOVO于近日与拥有下一代预防性和治疗性疫苗技术的新兴生物技术公司艾棣维欣(苏州)生物制药有限公司宣布就新冠肺炎DNA候选疫苗INO-4800签订合作和许可协议,艾棣维欣将具有独家授权在大中华区(包括中国大陆、香港、澳门和台湾)开发、生产及商业化INO-4800。艾棣维欣将许可INOVIO在生产INO-4800及其他INOVIO产品线的候选产品时使用其质粒生产工艺,同时授予INOVIO的生产伙伴再许可的权利。
→INOVIO携手艾棣维欣商业化新冠候选疫苗 | 美通社
[1]最全「新冠疫苗」大盘点,一表读懂!
相关推荐
全球多地正式开始接种,200余项新冠疫苗正在研发,药企聚力阻击新冠疫情 | 2020盘点
盖茨:终结新冠疫情唯一方法是全球70亿人都接种疫苗
新冠肺炎疫苗生死时速,中、美、欧疫苗研发五大赛道盘点
靠做新冠疫苗,药企能赚大钱吗?
新冠疫苗大竞赛:我们离全球重启还有多远?
研发到了哪一步?哪些人需紧急接种?新冠疫苗五问五答
全球第一个获批的新冠疫苗来了,终结疫情还远吗?
全球超175支新冠候选疫苗“参赛”,谁能最先出线?
70亿人苦等新冠疫苗救命,却有人反对疫苗
“全球首个”新冠疫苗下周英国面市,国产疫苗的显著进展更需受关注
网址: 全球多地正式开始接种,200余项新冠疫苗正在研发,药企聚力阻击新冠疫情 | 2020盘点 http://www.xishuta.com/newsview38397.html
推荐科技快讯

- 1问界商标转让释放信号:赛力斯 95792
- 2报告:抖音海外版下载量突破1 25736
- 3人类唯一的出路:变成人工智能 25175
- 4人类唯一的出路: 变成人工智 24611
- 5移动办公如何高效?谷歌研究了 24309
- 6华为 nova14深度评测: 13155
- 7滴滴出行被投诉价格操纵,网约 11888
- 82023年起,银行存取款迎来 10774
- 9五一来了,大数据杀熟又想来, 9794
- 10手机中存在一个监听开关,你关 9519