焦点分析 | 首个新冠口服特效药上市,能否搅动“抗疫”市场格局?
11月4日,默沙东/Ridgeback宣布英国药品和保健产品监管局(MHRA)已在英国批准莫努匹韦(molnupiravir)上市,用于治疗重症和住院风险较高的轻至中度COVID-19成人患者。
Molnupiravir是全球首个获批用于治疗成人轻度至中度COVID-19的口服抗病毒药物,这些患者经SARS-CoV-2诊断测试呈阳性且至少存在一个发展为严重疾病的风险因素。
据悉,Molnupiravir最初是针对委内瑞拉马脑炎病毒的药物,研究发现其对SARS、MERS等冠状病毒有效,后转化成为新冠特效药。
目前,Molnupiravir由默沙东和Ridgeback公司共同开发,Ridgeback从默沙东获得了首付款,未来还将基于临床开发和注册进展获得里程金。两家公司未来将平分药物销售后的利润。
今年6月9日,默沙东曾与美国政府签订了一项采购协议,一旦获得FDA的紧急使用授权(EUA)或者正式批准,将向美国政府提供170万疗程(约12亿美元)的molnupiravir药物。由此估算,molnupiravir平均每疗程约706美元。
在上周举办的第三季度财报电话会议上,默沙东预计,如果在今年12月顺利获得EUA,molnupiravir将在2022年获得50亿-70亿美元销售额。默沙东及Ridgeback还表示,他们已经与联合国成一项治疗许可协议,允许105个低收入和中等收入国家共享该药。
首个获批的“抗新冠”口服药
这款药的意义何在?它是全球首个获批的抗新冠病毒口服药。
据悉,口服药可用于暴露前或暴露后预防,减少病毒/感染潜在传播,对免疫应答缺乏的患者进行治疗,同时口服药物比抗体药物给药更加便捷、可及性强、产能限制更小、社会成本更低。
具体来说,针对小分子药物能够进入细胞内部,对病毒复制和入胞过程起到抑制作用,这是生物药物无可比拟的;此外,可口服的小分子药物存储和运输方便,给药方式友好,对医疗环境的要求低。
作为口服的小分子药物,Molnupiravir的结构式并不复杂,且是核苷类似物 N4-羟基胞苷(NHC)的口服前体药物,合成难度较低。相较之下,抗体药物的生产则需要依赖生物制药方法生成,耗时耗材。
上述优势均将使Molnupiravir在新冠这种全球大流行病的治疗中具有重要治疗意义。
在此之前,在小分子药物领域,已有两款药获批上市或获批紧急使用,用于治疗新冠肺炎,分别为吉利德的瑞德西韦(注射液)、礼来制药的巴瑞替尼(片剂)。
其中,瑞德西韦已于2020年10年在美上市,用于治疗12岁及以上、体重至少达到40公斤且需住院的新冠患者;巴瑞替尼则在2021年7月获FDA紧急使用授权,可单药治疗新冠住院患者。不过,二者均属于“老药新用”,疗效存在争议。

图片来源:中信建投研报
此次Molnupiravir的获批主要基于III期MOVe-OUT研究的数据:molnupiravir治疗组的住院和死亡风险降低了50%,而且在29天内未见患者死亡报告,安慰剂对照组报告8例患者死亡。
究其原理,中信建投研报显示,Molnupiravir是一种核苷类药物,血浆酯酶代谢物通过干扰RNA的合成而起作用 ,其代谢物造成病毒基因合成的高突变率,最终导致病毒死亡。由于RNA聚合酶在RNA病毒中结构相对保守,而该药物正是作用在RNA聚合酶,因此可对多种变异株有效。
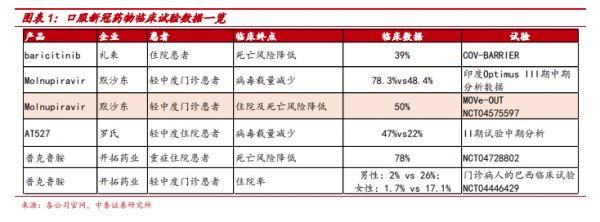
当前口服新冠药物试验数据一览图
但也有专家在接受DeepTech深科技采访时指出,molnupiravir 这样的小分子口服药也存在一定的局限:首先,狭窄的给药窗口,即越早使用越有效,到后面则效果不佳;其次,对重症患者的作用不大——默沙东试验结果表明,“在患病早期服用 molnupiravir 才能产生效果”。
值得一提的是,小分子药物还存在耐药性,一般需要联用才能保持疗效。
新的抗疫组合拳
其实,除了小分子口服药物,新冠特效药还有大分子药——中和抗体。
当病毒、细菌等病原微生物入侵人体后,会刺激人体内的免疫系统,产生多种抗体。但只有部分抗体能够迅速识别病原微生物,与其表面的抗原结合,阻止该病原微生物结合靶细胞表面的受体侵入细胞,以保护人体不被感染。这个过程为中和作用,发挥作用的抗体则称为中和抗体。
简言之,不像小分子药可阻断病毒增殖,中和抗体药物则是向人体注射抗体,阻断病毒与人体结合,实现疗效;疫苗则是以可称为“假病毒”的抗原来诱生人体产生抗体。
中和抗体由新冠肺炎康复患者血清中分离获得,针对新冠病毒刺突蛋白受体结合域(RBD),包裹其侵入细胞的功能区域,阻碍病毒对细胞的感染过程。由于具有研发快、特异性强、副作用相对较小,疗效确切性强的特点,中和抗体可快速应对突发的大规模流行感染。
在新冠病毒中和抗体领域,诸多药企也有布局。其中走得比较靠前的是再生元/罗氏、礼来制药/君实生物的双抗疗法,它们均已获得美国紧急使用授权,用于治疗轻度至中度新冠肺炎患者。
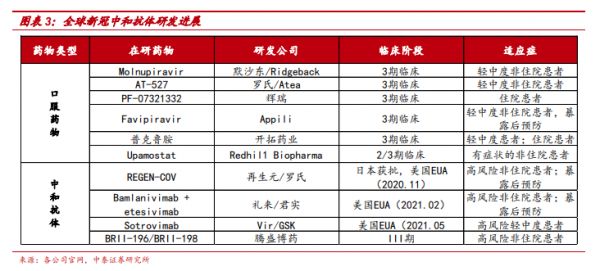
图片来源:华盛证券
而相比小分子口服药,中和抗体药物有一个优势——不仅可以用于治疗,也可以用于预防。再生元、礼来制药的双抗疗法即获批用于“特定人群的暴露后预防”。
其中,特定人群代指两种:其一,不适合接种疫苗的人群,二是接种疫苗后可能出现突破性感染的人群,他们可能年龄较大、身体状况较差,要预防其发展成重症。因此,中和抗体药物又可视作疫苗的补充。
不过,中和抗体也有一些不可忽视缺点:
首先,中和抗体只能保证短期预防,需要每1个月或每2个月打一针;
其次,病毒变异或导致疗效降低。不同的新冠中和抗体药物靶向不同的表位,应对不同的变异病毒效果存在差异;
最后,成本高昂。中和抗体药物中含有的蛋白量较高,产能受到限制,因此成本和价格也相对较高。今年年初,美国政府宣布将以约26.3亿美元的价格购买125万剂再生元的新冠中和抗体,平均每剂价格超过2000美元,约是Molnupiravir每疗程价格(706美元)的三倍。
综合来看,小分子口服药和中和抗体各有优劣,不是非黑即白的关系,且针对的受众有别,还能针对疫苗的“极限”效果予以补充。未来,疫苗、小分子口服药、中和抗体药物三者将构成抗击新冠病毒的组合拳。
重构“新冠”相关市场格局?
不过值得关注的是,此前在Molnupiravir的“刺激”之下,不少企业随即公布了其新冠治疗药物的最新进展,尽量让自己“不落下风”,譬如:
君实生物就在上月初宣布,与旺山旺水生物医药达成合作,双方将共同承担口服核苷类抗新冠病毒候选药物VV116在全球范围内的临床开发和产业化工作;
开拓药业也公告称,普克鲁胺治疗住院新冠患者的III期全球多中心临床试验已在美国的临床中心完成首例患者入组及给药;
腾盛博药于10月10日披露,在BRII-196/BRII-198联合疗法的ACTIV-2三期临床研究取得积极数据基础上,向FDA递交了新冠中和抗体BRII-196/BRII-198的紧急使用授权申请;
另外还有绿叶制药的LY–CovMab、复宏汉霖的HLX70、济民可信的JMB2002、神州细胞的SCTA01尚在早期临床阶段。
然而,其中以新冠中和抗体主导的药企,像开拓药业、腾盛博药等股价今日都应声下跌;新冠疫苗概念股中国生物制药、沃森生物、智飞生物亦是如此,均受到了Molnupiravir获批消息的冲击。不过,这并不能指向各自的市场表现,未来市场格局难下定论。
如前文所言,疫苗、特效药能在疫情防控的不同阶段分别发挥作用:第一个阶段是预防,主要依赖自身防护和疫苗;第二个阶段暴露预防,依靠部分中和抗体;第三个阶段是确诊后治疗,以中和抗体和小分子药物的治疗为主。
在新冠疫苗方面,即便疫苗已实现大范围接种,但加强针的落地也意味着新冠疫苗的供需拐点或尚未达到,新冠疫苗还将是各疫苗公司重要的业绩支柱。
国信证券研报此前测算,按照现阶段疫苗提供的免疫保护仅能维持6个月到1年左右的情况,要满足全球人口达成初步群体免疫,再加上每8~10个月对全球80%以上人口进行加强免疫的条件,预计在2022年底新冠疫苗可达到供需平衡,之后每年约需要80亿剂稳定加强免疫需求。
在新冠特效药方面,瑞德西韦2020年H2实现销售收入28.11亿美元,2021年H1实现销售收入22.85亿美元,足见市场对于新冠药物仍然表现出强烈的需求,未来新冠特效药还将享受一定的市场红利。
简言之,未来不论是疫苗,还是中和抗体药,亦或是小分子药,市场需求均将持续一段时间。
相关推荐
焦点分析 | 首个新冠口服特效药上市,能否搅动“抗疫”市场格局?
治疗新冠:中国及全球“特效药”研发的好消息与坏消息
“全球首款”新冠特效药要来了?真相在这里
被寄予厚望的新冠药物瑞德西韦,背后是一家怎样的传奇公司?
抗疫新药启动三期临床试验,医药投资人:动作很快,有戏
拯救绝症猫咪的神药,会是治疗新冠的真正特效药吗?
焦点分析 | 「瑞德西韦」获批上市:是吉利德翻盘的希望,未必是人民的希望
瑞德西韦,距离真的成为新冠特效药还有多远?
新冠疫苗,盛宴近尾声
李飞飞团队加入AI抗疫:家用监控系统,可以远程反馈新冠症状
网址: 焦点分析 | 首个新冠口服特效药上市,能否搅动“抗疫”市场格局? http://www.xishuta.com/zhidaoview22280.html
推荐专业知识

- 136氪首发 | 瞄准企业“流 3930
- 2失联37天的私募大佬现身,但 3220
- 3是时候看到全球新商业版图了! 2809
- 436氪首发 | 「微脉」获1 2759
- 5流浪地球是大刘在电力系统上班 2708
- 6招商知识:商业市场前期调研及 2698
- 7Grab真开始做财富管理了 2610
- 8中国离硬科幻电影时代还有多远 2328
- 9创投周报 Vol.24 | 2186
- 10微医集团近日完成新一轮股权质 2181










