中国阿尔茨海默病新药争议:别高兴太早,也别忙着质疑
编者按:本文来自微信公众号“八点健闻”(ID:HealthInsight),作者 吴靖、吴晔婷,36氪经授权发布。
导读
全球共有5000万阿尔茨海默病患者,过去20多年,各大药企投入数千亿美元研发新药,但屡战屡败,已有320余个进入临床研究的药物宣告失败。
针对阿尔茨海默病,目前只有5款药物可用,但疗效均不显著,中国新药九期一®获批前,全球已经17年没有新药上市了。
但九期一®面临诸多争议,例如药理不明确、试验数据存疑、试验周期过短、制药公司在历史上曾涉嫌夸大宣传等等。
这是历史性的新药,还是又一次夸大宣传?一切要等更多临床数据出来才能判断。
11月2日,国家药监局官网发布公告,有条件批准轻度至中度阿尔茨海默病药物甘露特钠胶囊上市。
这是上海绿谷制药有限公司、中国海洋大学、中国科学院上海药物研究所联合研发的新药,代号:GV-971,商品名九期一®。
阿尔茨海默病(AD),是老年痴呆的一种,全球约有5000万患者,社会痴呆相关成本达1万亿美元。中国大约有1000万患者。
人类对阿尔茨海默病的新药,有着极其强烈的临床需求。至今全球药企已经投入上千亿美元进行研发,但可以说屡战屡败、屡败屡战。
到现在为止,只有5款延缓病情的药物获批上市,而且效果都不明显。从2002年开始,已经17年没有新药上市。
所以,九期一®的获批,称得上是历史性的消息。
但是,九期一®也带来了巨大的争议。
例如,推出这款药的绿谷制药,过去很多年把保健品当作“抗癌神药”销售,而被中央电视台、南方周末等媒体曝光。九期一®的药理与此前的AD药物截然不同,临床试验数据也被认为存在不少问题。
AD新药研发屡战屡败,过去17年无药获批
阿尔茨海默病的病因至今不明,药物研发也极其艰难。就在上个月,美国生物科技公司百健宣布,半年多前刚宣布失败的阿尔茨海默病新药原来是有效的,将在2020年初向FDA提出上市申请。这已经是峰回路转的历史性消息,一宣布就让百健公司的股价上涨超过30%。
根据《2018年世界阿尔茨海默病报告》(WorldAlzheimerReport2018)统计,2018年全球约有5000万AD患者,社会痴呆相关成本达1万亿美元。据估计,到2050年预计全球AD患者将增加至1.52亿人。
目前,经过美国FDA批准使用的药物只有5种,且均为症状改善类药物,仅可轻度改善患者的认知功能。
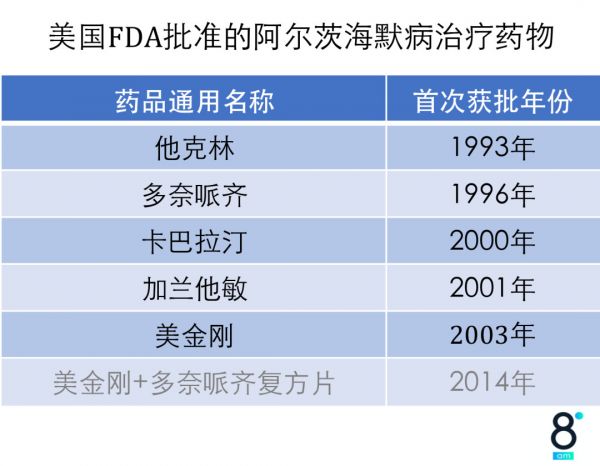
自从2002年的美金刚获批后,全球AD新药已有长达17年处于空白期。而在5种获批药物背后,另一个需要关注的数字是:在过去的20多年中,全球各大制药公司相继投入数千亿美元研发,已有320余个进入临床研究的药物宣告失败。这些AD药物研发失败的原因主要是没有疗效和出现不良反应。

△来源:微信公众号“同写意”。
而根据医药市场研究机构EvaluatePharma的数据统计,截至2019年9月,本年度全球在阿尔茨海默病的研发投入达390亿美元。
长期以来阿尔茨海默病药品研发的困境,是这次九期一®的突破获得如此高关注度的重要原因。
九期一®作用机理:靶向脑-肠轴机制
根据11月3日上海市政府举行的新闻发布会披露的信息,九期一®是由中国科学院上海药物研究所耿美玉研究员领导研究团队,坚持22年,在中国海洋大学、中国科学院上海药物研究所与上海绿谷制药有限公司接续努力研发成功的原创新药。该药品的药理机制是靶向脑-肠轴。
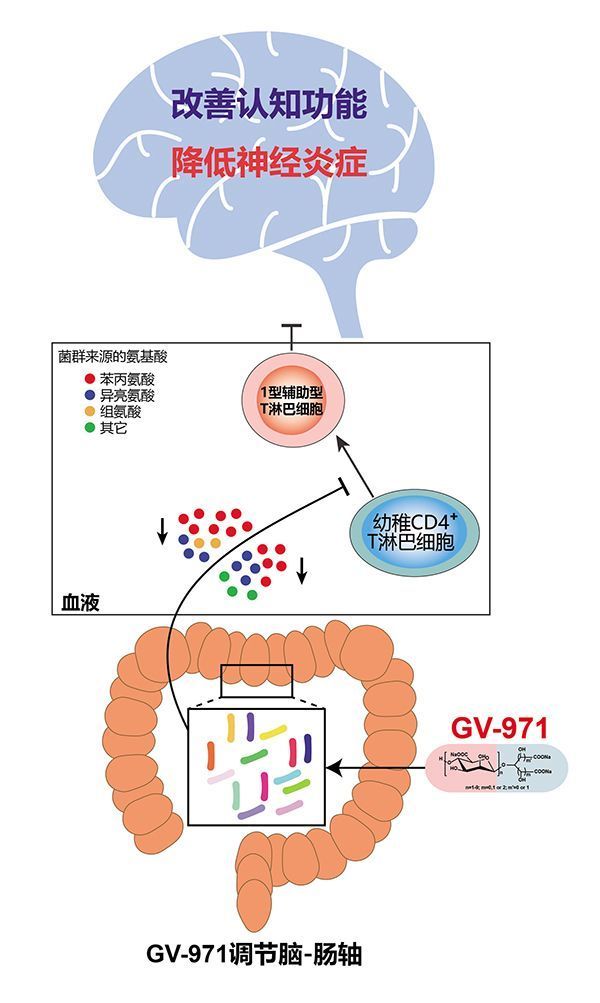
要理解靶向脑肠轴机制,需要理解肠道菌群与大脑中枢神经之间的关联。近年来的研究表明,作为机体的重要组成部分,肠道菌群的作用不仅限于胃肠道,还对脑功能和行为起到了重大的影响。肠道菌群参与调控脑发育、应激反应、焦虑、抑郁、认知功能等中枢神经系统活动。在AD研究领域,一个逐渐被证实的“卫生学假说”是,AD可能始发于肠道,并与肠道菌群的失衡密切相关。
耿美玉团队研究发现,肠道菌群的变化会引起苯丙氨酸和异亮氨酸在外周血内的积累,从而导致神经炎症的发生,最终产生认知功能障碍。

临床试验数据:可改善患者认知功能障碍
共有1199例受试者参加了九期一®的1、2、3期临床试验研究。
根据目前所公布的数据,为期36周的3期临床研究结果表明,九期一®可明显改善轻、中度阿尔茨海默病患者认知功能障碍,与安慰剂组(对照组,安慰剂外观类似真药,但不含活性成分)相比,主要疗效指标认知功能改善显著,认知功能量表(ADAS-Cog)评分改善2.54分(p<0.0001)。对患者的认知功能具有起效快、呈持续稳健改善的特点,且安全性好,不良事件发生率与安慰剂组相当。
上海绿谷制药有限公司董事长吕松涛介绍,九期一®即将于11月7日投产,并于12月29日前将把药物铺到全国的渠道。上海浦东张江已经提供40亩地用于产业化建设,新工厂今年内动工,如果建设三年能够完成的话,这个工厂可以满足每年200万患者用药量的生产、销售。
有条件批准:上市后进一步提交试验数据
在药监局的药品上市审批说明中,有一个特别的限定词——“有条件批准”,药监局要求药品上市后“申请人继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关试验数据”。

而能够实现“有条件批准”的政策基础是药品上市许可持有人制度(简称“MAH”),指的是拥有药品技术的药品研发机构、科研人员、药品生产企业等主体,通过提出药品上市许可申请并获得药品上市许可批件,并对药品质量在其整个生命周期内承担主要责任的制度。
早在2016年6月,国务院印发《药品上市许可持有人制度试点方案》。这一制度改革加速了中国新药的研发速度,让新药有机会先完成再完美。
质疑是自然的
虽然是历史性的消息,但九期一®存在诸多争议。
质疑点之一就是该药是由一个曾经涉嫌虚假宣传的制药公司联合开发的。绿谷制药之前的一个大卖的产品是中华灵芝宝(后更名双灵固本散),这是一个保健品,却以“抗癌神药”宣传。
2002年和2008年,南方周末和中央电视台《每周质量报告》分别以《“中华灵芝宝”还要骗多久?》和《揭秘“绿谷”骗局》为题报道该产品,称其虚假宣传。
还有人质疑,九期一®的信号作用通路和作用机理并不明确,比如这个药物能够调控肠道的哪个细菌,调控通道是什么,作用位点是什么,都没有说清楚。
浙江大学教授、科学作家王立铭认为,对这个药的质疑是自然的。但他同时认为,自然,不代表就是对的。
王立铭在他的微博上说,“人类历史上我们吃理当如此的亏也吃的足够多了,……比如屠呦呦搞出来的青蒿素,放在时代背景下其实也可以让人疑窦丛生。你一个博士学位都没有的实验员,从一千多年前医本充满巫术的医书里得到灵感,然后就找到了一个抗疟神药?但是真的就是真的,青蒿素经受了所有严苛的临床检验,今天已经是造福世界的神药。但是更有意思的问题在于,即便你拥有今天所有后验的知识,穿越回1960年代,你就能拍胸脯说青蒿素就是神药吗?不能啊”。
临床试验存在诸多疑点
在知乎和微博,很多人对药物临床试验也提出了质疑。
首先,药物临床试验所用的评价量表因过于单一,被很多人认为说服力不强。FDA曾建议药厂开发AD药物时尽量多用集中认知量表保证测量的精度。ADAS指的是阿尔茨海默症评定量表,cog是指认知部分的分量表。
九期一®药物临床实验中所用的是ADAS-cog12这个分量表,是一个满分为70分的试卷。根据结果,服药9个月后,轻中度测试分比不用药只改善了2.54分,重度比不用药改善了4.55分,也就是说,轻中度和重度患者相比不用药患者,都改善了10%。虽然看起来10%是个不错的变化,但用了十多年的美金刚,也是10%的变化,由此来看,九期一®的变化幅度并不算大。
此外,该试验采用的主要是主观评价体系,上述的认知量表就是属于主观的评价体系,而恰恰没有令人信服的可量化的客观指标。
有质疑者认为,单用主观的评价体系会影响数据的准确性。“这是一个认知测试,做过题目的同学都知道,如果测试内容相近,肯定测试结果要一次比一次好。”
这种主观指标,有一个专有名词叫患者汇报结局,属于卫生经济学与结果研究中的结果研究。一般通过病人自填或者访谈的形式,在这个过程中,难以避免试验人员的主观性。临床试验中可能会存在的问题或情况是,试验人员有意或无意引导病人得出自己想要的答案,数据就有偏差。
“从现在的结果上来看,面试官诱导回答的可能性不能排除,因为第24-36周的变化太大,没有合理的解释”。

另外,对照组患者(吃安慰剂)的选取让人困惑,该试验对照组患者选取的是轻中度AD患者。有不少人疑惑,试验中,对照组患者的病情表现很奇怪,前期出现先骤然改善然后又突然下降到一开始的状态。一般来说,没有吃药的轻中度AD患者的ADAS-cog评分不会出现快速的起伏,而是水平稳定或逐步恶化。
昨晚,一位国内著名生物科学家在朋友圈分别晒出了九期一®三期临床试验和多奈哌齐的三期临床实验截图。多奈哌齐于1996年被美国FDA批准上市,针对轻中度AD患者有疗效。
但是对比两个实验的对照组患者,在都没服用治疗药物的情况,患者的病情变化截然不同,多奈哌齐对照组患者在前六周病情有所改善后,之后一直呈下降趋势,恶化。“两个图都有安慰剂,但结果不同,可能因为病人不同,或安慰剂成分不同”。
36周的试验还不够,需要更长时间验证
如果不想试验数据准确性被别人诟病,最好的做法是,主观与客观评价体系都要使用。
有生物统计学家质疑,该实验只看了记忆障碍、失语、失认视空间技能损害、执行功能障碍以及人格和行为的改变,而这些都是痴呆症患者几乎共有的问题,AD症是痴呆症其中一种。
怎么样能够分辨这些指标是只针对AD患者的呢?AD患者的客观评价指标可以通过查血、查脑脊液还是脑磁共振或者其他影像学手段得到。
病理上的变化就是客观评价指标之一。该试验恰恰没有显示出AD患者在服药后神经元数量的变化,AD患者相较于普通人,神经元会少很多,服药后神经元数量是否上升应作为判断AD患者是否好转、药是否起效的重要因素之一。
2018年,美国FDA公布了有关阿尔茨海默症的监管指南,提出对于早期阿尔茨海默症患者,可以通过生物标志物的改善作为疗效的证据。
但在这个研究中,很多人质疑,没有看到经典的生物标志物检测数据。经典的生物标志物是指脑脊液Abeta/tau的生物标记物。现在全球市场上大部分AD药物试验都会同时测量Abeta/tau这样的生物标记物。
该试验仅用PET观察葡萄糖提取一个次要终点指标,脑脊液相关Abeta/tau等蛋白都没有列入终点指标。
与此同时,该药物临床试验披露数据并不多,与这个药相关的药理、毒理等临床数据都没有披露。
更加值得注意的是,九期一®的药物临床试验时间显然还不够长,只有36周,未来还有待时间检验。
从以往研发厂商的失败经历来看,AD一直是新药研发的重灾区,该领域研发失败率高达99.6%。过去几年,包括礼来、阿斯利康、强生、辉瑞、罗氏在内的制药巨头投资达数十亿美元的多个单抗药物均在III期临床惨遭失败。
礼来公司的solanezumab做了3个三期,最终失败,40周的时候还有改善的效果,但到80周时发现无效。再说现在的症状控制药物美金刚,试验数据显示,36周仍然对AD患者有改善效果,但12个月以后,就开始无效。
从这个角度看,一定程度上可以理解药监局发布的信息,“国家药监局要求申请人上市后继续进行药理机制方面的研究和长期安全性有效性研究,完善寡糖的分析方法,按时提交有关时间数据”。
王立铭在微博上说,“更多的分析还需要等上市后的临床数据出来。是第二个青蒿素,还是第二个韩春雨(曾发表论文公布基因编辑技术,被称为‘诺奖级’实验结果,后被质疑实验无法重复,韩春雨团队主动撤回论文),拭目以待。我希望是前者”。
相关推荐
中国阿尔茨海默病新药争议:别高兴太早,也别忙着质疑
国产阿尔茨海默病新药获批,但攻克AD之路依旧漫长
最前线 | 阿尔茨海默病新药上市,十五年来首次获批,曾被实名举报研究造假
新阿尔茨海默症药物诞生,FDA为什么犹豫未批?
观察+ | 阿尔茨海默症等来了“灵丹妙药”?谨慎看待不“捧杀”
VR识别早期阿尔茨海默症胜过“金标准”,准确率约为90%
治疗阿尔茨海默氏症,免疫系统可能是新的突破口
以“阿尔兹海默症”为案例,AI+慢病管理该怎么做?
在瑞士巴塞尔生命大会,我们带回了阿尔兹海默症的最新疗法 | 36氪新药新疗法
中国世界500强数量首超美国,但别高兴得太早
网址: 中国阿尔茨海默病新药争议:别高兴太早,也别忙着质疑 http://www.xishuta.com/zhidaoview4112.html
推荐专业知识

- 136氪首发 | 瞄准企业“流 3930
- 2失联37天的私募大佬现身,但 3220
- 3是时候看到全球新商业版图了! 2809
- 436氪首发 | 「微脉」获1 2759
- 5流浪地球是大刘在电力系统上班 2708
- 6招商知识:商业市场前期调研及 2698
- 7Grab真开始做财富管理了 2610
- 8中国离硬科幻电影时代还有多远 2328
- 9创投周报 Vol.24 | 2186
- 10微医集团近日完成新一轮股权质 2181










